强生的重磅单抗药物类克(Remicade,注射用英夫利西单抗)是上一代重磅药物的重要代表,可用于多种自身免疫疾病,其在过去五年里价格上涨了63%。4月5日,FDA批准了辉瑞公司和Celltrion公司的的生物类似药infliximab-dyyb,后者是Remicade的首个生物类似药。

Remicade的适应症
什么是生物类似药?
生物类似药(Biosimilar),又译为“生物仿制药”,其定义在不同国家间有所差异。美国FDA相关指南规定,生物类似药和原研药品之间应该无临床意义的差异;欧洲药品管理局(EMA)规定二者应该本质上是相同的生物物质。在中国,生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。
美国畅销“原研药”的价格变化
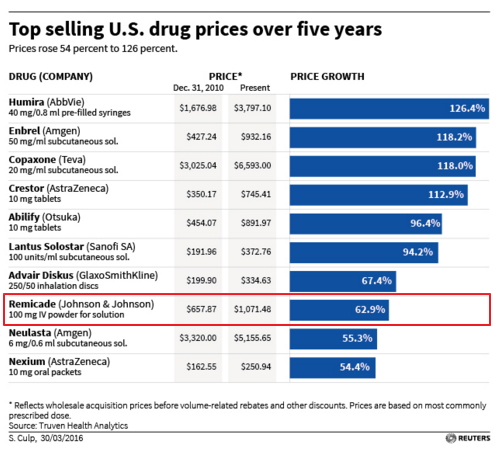
注射用英夫利西单抗Remicade是上一代重磅药物的重要代表,可用于多种自身免疫疾病,其在过去五年里价格上涨了63%。2014年,Remicade的全球销售额为102亿美元,成功晋级年度重磅销售药物的前三甲。在过去,生物类似药因为技术难度大、开发成本高、开发风险大等特点,一般价格上没有小分子仿制药优势大;欧洲多年的经验表明生物类似药一般比原研药物便宜20-30%,所以原研药还有很大的竞争力。
FDA批准Remicade首个生物类似药

infliximab-dyyb(左:辉瑞Inflectra,右:Celltrion公司Remsima)
Remicade(英夫利昔单抗,infliximab)为静脉注射用冻干浓缩液,适用于克罗恩病、溃疡性结肠炎、强直性脊柱炎、银屑病关节炎、斑块性银屑病。4月5日,FDA批准了辉瑞公司和Celltrion公司的的生物类似药infliximab-dyyb(辉瑞的商品名Inflectra,Celltrion的商品名Remsima),辉瑞公司在2015年完成的170亿美元收购Hospira公司的交易中继承了仿制药Inflectra的市场销售权。作为Remicade的生物类似药,infliximab-dyyb可在所有Remicade适应症的使用。
根据pmlive.com的报道,这是继去年FDA批准诺华旗下山多士的Zarxio(安进Neupogen的生物类似药)之后,FDA批准的第二个生物类似药,但Zarxio是粒细胞集落刺激因子,技术难度低于单克隆抗体Remicade。infliximab-dyyb的批准标志着生物类似药全面进军美国市场。
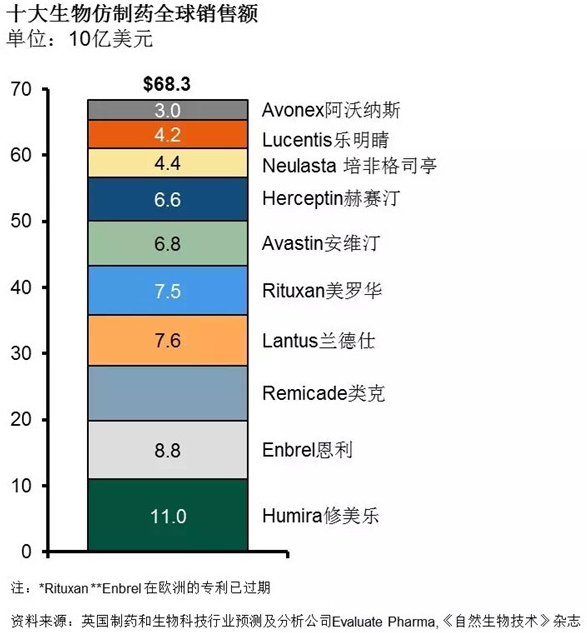
生物类似药市场潜力无限
根据IMS最新数据显示:截止2020年,仅在欧美地区,生物类似药的市场将达到1100亿美元。随着专利药的到期,未来5年,生物类似药将抢占20%的市场,预计相关品牌生物制剂与生物仿制药在价格上的差异将进一步拉升。
2011年至2017年,是世界制药史上商标名药品专利到期的又一高峰时段,一些大型跨国制药公司陆续有一半以上价值770亿美元的药品专利过期、美国新医改将在未来10年内消耗约1万亿美元,这两个数字无不刺激着制药企业敏感的神经。但受限于新药研发技术以及各国首仿政策的制约,尽管仿制药市场广阔,相关企业仍旧难以顺利喝下“仿制药甜羹”。
而洞察到相关仿制药市场困境后,当前越来越多的制药企业开始将目光转向生物类似药市场。如除诺华子公司山德士(Zarxio)、强生(Remicade,其2013年全球销售额达84亿美元)、默沙东(SB2(Remicade)、SB3(Herceptin)、SB4(Enbrel)、SB5(Humira)、MK-1293(Lantus))、百时美施贵宝(Yervoy、Opdivo、Erbitux)等实力强劲的外企外,国内的中信国健、贝达、华海、海正、恒瑞、丽珠、人福、华兰等一批具有生物药开发能力的本土企业也在朝生物类似药市场发力。
对于众多制药企业如此发力于生物类似药市场,其实与相关政策的鼓励不无关系。各国相关政策的颁布,无疑给大批制药企业涌进生物类似药市场带来了信心,对仿制厂家十分有利。
2016年3月31日,美国FDA发布了生物类似产品标签指南草案,明确指出生物类似产品标签不应包括仅支持证明所提生物类似产品和参照产品对于获批适应症无临床意义的差异的临床研究的描述。
2015年2月28日,中国CFDA旗下药品审评中心(CDE)发布了《生物类似药研发与评价技术指导原则(试行)》,确定了生物类似药的监管框架,为生物制药在中国的上市提供了另一途径;还希望制药公司提交生物类似药的详细结构和功能特性以便与参照药进行比较;并采取了与发达国家相似的渐进式方法,通过比较药理学数据、非临床研究和临床研究以评价相似性。
推荐阅读


